Combinado la microscopia STED, una tecnología que permite la visualización con superresolución, y un nuevo anticuerpo creado recientemente, investigadores de la Universitat Autònoma de Barcelona (UAB), el Instituto Karolinska (KI) y la empresa de biotecnología BioArctic, ambas de Suecia, han avanzado en el conocimiento de los agregados amiloidogénicos característicos de la enfermedad de Alzheimer.
Este trabajo ha conseguido superar las capacidades de la microscopia confocal convencional, lo que permitirá profundizar en el estudio de la estructura y morfología de los depósitos de amiloides y de los mecanismos implicados en su formación.
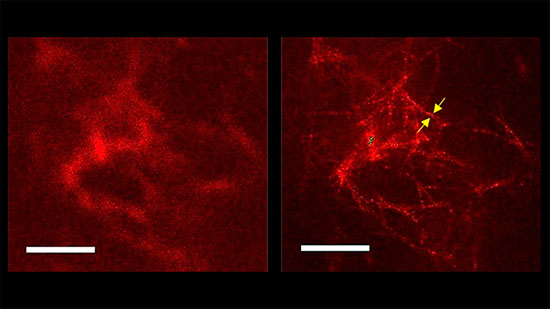
En el cerebro de los pacientes con enfermedad de Alzheimer hay acumulaciones de placas de agregados de proteína beta-amiloide (Aβ), que se han relacionado con el deterioro del tejido y el mal funcionamiento cerebral. El componente principal de estas placas son cadenas de unos 40-42 aminoácidos, que con la microscopia de luz confocal convencional solo se pueden describir en términos colectivos como placas amorfas, densas o difusas.
Esta visión clásica está lejos de las fibras individuales vistas con microscopia electrónica. Con esta herramienta, parece que tienen forma de hilo, de entre 6 y 10 nanómetros de diámetro, sin ramificaciones y a menudo formadas por filamentos enrollados unos en torno a otros. Sin embargo, aunque la microscopia electrónica ofrece una mayor resolución, tiene varios inconvenientes, como un coste muy elevado y un proceso de preparación de las muestras que aumenta el riesgo de contaminación.
En este estudio, el equipo de investigadores ha evaluado el uso de un tercer tipo de microscopia, la STED (de las siglas en inglés de agotamiento de emisiones estimuladas), para examinar la estructura y morfología de los agregados de proteína beta-amiloide (Aβ). Con esta tecnología, desarrollada por el ganador del premio Nobel S. W. Hell, han examinado secciones cerebrales de ratones modelo de la enfermedad de Alzheimer, junto con un nuevo anticuerpo recombinante humano marcado con una fluorescencia que reacciona selectivamente con los agregados Aβ.
El trabajo, publicado en la revista Cell & Bioscience, describe detalles de la estructura de la placa de depósitos de amiloides que no se habían podido resolver con la microscopia de luz convencional. Tal y como destaca el Dr. Björn Johansson, investigador del Departamento de Neurociencia Clínica del Instituto Karolinska y primer autor del artículo, «hemos conseguido una resolución espacial que supera de 5 a 10 veces las capacidades de la microscopia de luz confocal convencional, tanto en muestras in vitro como en secciones de tejido cerebral, y hemos podido discernir las fibras individuales dentro de las placas, un hito antes solo posible con microscopia electrónica».
En este sentido Vladana Vukojevic, coautora e investigadora del mismo departamento, añade que «es un avance importante en el campo, que nos permitirá profundizar en la caracterización de los mecanismos implicados en la deposición de Aβ en placas y su posterior eliminación«.
Por su parte, Lydia Giménez-Llort, investigadora del Departamento de Psiquiatría y Medicina Legal y del Instituto de Neurociencias de la UAB, coautora del estudio, recalca que “la capacidad de obtener estas imágenes en animales que hayan estado bajo observación conductual nos ha de permitir entender mejor el desarrollo y progresión de los síntomas cognitivos y neuropsiquiátricos, con el objetivo de encontrar correlatos bioquímicos y neuropatológicos significativos”.
Los autores coinciden en que en los estudios anteriores de la enfermedad de Alzheimer hechos mediante microscopia de luz convencional falta una información que ahora se podrá abordar con esta nueva metodología, sobre el papel de los agregados beta-amiloides en la patogénesis de la enfermedad. “La microscopía STED se perfila como una herramienta indispensable para impulsar el progreso científico en la investigación del Alzheimer”, concluyen.
Las personas interesas pueden consultar aquí el estudio «The interwoven fibril-like structure of amyloid-beta plaques in mouse brain tissue visualized using super-resolution STED microscopy», publicado en la revista Cell & Bioscience.



